医疗器械风险管理务实
浏览次数: 次
【课程概要】
医疗器械的设计开发必须确保安全性、有效性,为此制定了风险管理相关的法规和标准。但是医疗器械企业也必须追求运营效率。这两个方面是相互结合的一个整体。
本课程重点不是机械、孤立地讲解医疗器械风险管理要求(ISO14971)的标准条款本身,而是在总结医疗器械行业的风险管理最佳实践的基础上,重点讲解如何将风险管理要求与产品生命周期结合起来,特别是如何与设计控制结合起来。意图是帮助企业不仅满足医疗器械风险管理的监管要求,而且还要帮助企业提升高质量、低成本、高效率的医疗器械产品开发和管理的能力。
【课程结构图】
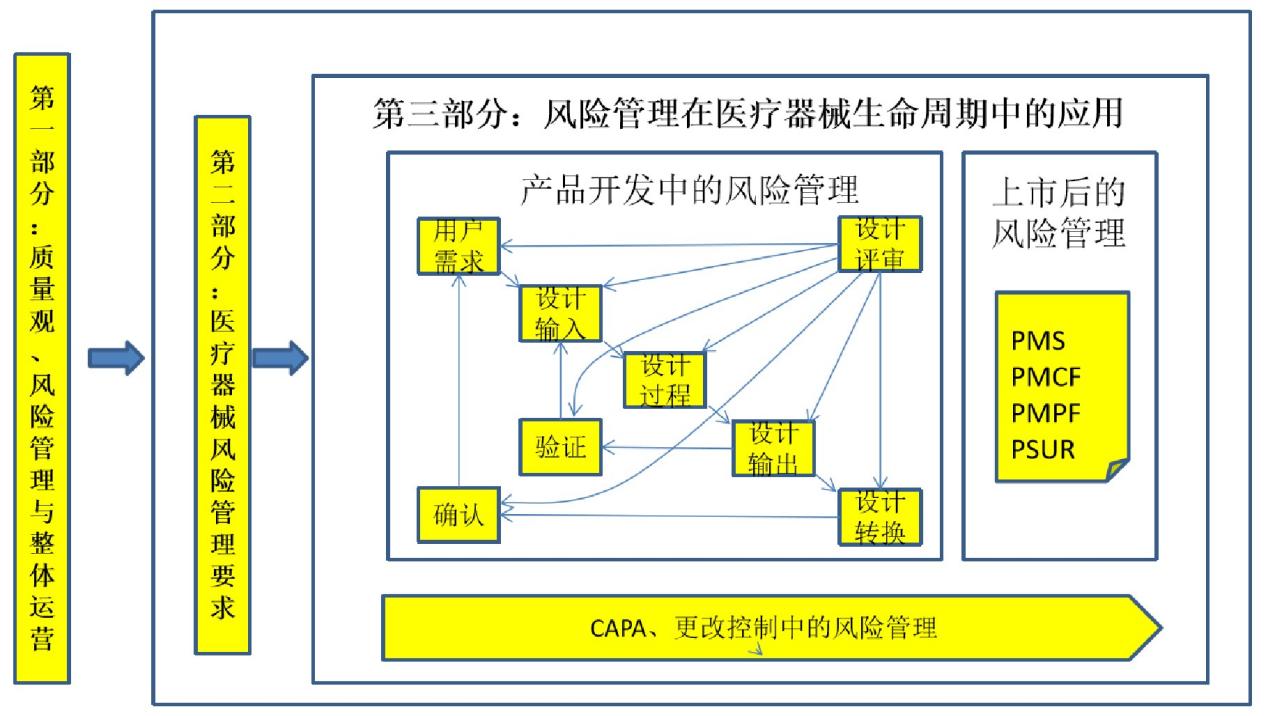
【培训对象】
研发、工程、质量、法规部门负责人
项目经理、设计师、设计转换工程师、质量工程师、法规工程师、体系工程师。
市场、销售、采购、生产部门主管。
【培训收益】
树立起全面管理的质量观,理解设计控制。
掌握风险管理要求基础知识
掌握风险管理如何与产品生命周期各个过程密切结合起来的要点。
借鉴学习医疗器械行业风险管理最佳实践,抄作业、少走弯路。
【课程特色】
从医疗器械的安全性、有效性与商业成功不可分割的观点出发,仅仅满足ISO14971风险管理条款的要求是远远不够的。本课程基于医疗器械最佳实践,讲述风险管理要求如何高效地与产品生命周期结合起来的系统工程方法。
【课程大纲】(12小时)
第一部分:质量观、风险管理与整体运营
1.引言
1.1.质量观
质量观决定质量管理的理念
传统质量观VS现代质量观
1.2.医疗器械质量体系与风险管理
风险管理与商业成功的不可分割性
1.3.设计控制与风险管理
设计控制闭环
风险管理概要
技术文件的概念
设计控制与风险管理文档
第二部分:医疗器械风险管理要求
2.医疗器械风险管理(ISO14971)详解
2.1.什么是产品风险管理?
2.2.术语和定义
2.3.产品风险管理通用要求
2.3.1.风险管理过程
2.3.2.管理职责
2.3.3.人员资格
2.3.4.风险管理文档
3.风险分析
3.1.风险分析过程
3.2.产品风险有关的特征的判定
3.3.危害的判定
3.4.估计每种危害状况的风险
4.风险评价
4.1.风险评价准则
概率的评价
严重度的评价
各种风险评价准则举例
5.风险控制
5.1.降低风险
5.2.风险控制方案分析
5.3.风险控制措施的实施
5.4.剩余风险的评价
5.5.风险/受益分析
5.6.风险控制的三原则和三顺序
5.7.风险控制措施引起的风险
5.8.风险控制的完整性
5.9.全部剩余风险的可接受性评价
6.风险管理报告
6.1.风险管理报告的内容
案例:风险管理报告模板
6.2.最早出现的风险管理报告
6.3.风险管理报告的动态性
7.生产和生产后信息
7.1.用于对产品操作者、使用者,或对产品安装、使用和维护负责的人提供的信息进行收集的机制
7.2.新的或修订的标准
7.3.收集和评审市场上的相似产品的公认的信息
将年度风险管理报告用于管理评审的输入
8.典型的风险管理工具及其案例
8.1.初步危害法”(PTA)
8.2.“故障树分析法”(FTA)
8.3.“失效模式和效应分析法”(FMEA)
8.4.“危害和可运行性研究法”(HAZOP)
8.5.“危害分析和临界点控制法”(HACCP)
第三部分:风险管理在产品生命周期中的应用
9.设计输入
9.1.用户需求与设计输入
案例分析:如何将用户需求转化为设计输入?
9.2.良好设计输入的特征
9.3.★讨论:设计输入VS技术解决方案
9.4.设计输入的风险分析
9.5.设计输入变更控制
★讨论:如何应对多变的用户需求?
10.设计过程
10.1.设计过程与设计输入的关系
10.2.总体设计方案关注的要点
流程性材料型产品的总体设计方案
离散型产品的总体设计方案
10.3.详细设计关注的要点
11.产品集成
11.1.确定产品集成顺序
11.2.建立产品集成环境
11.3.建立集成程序和准则
11.4.审查接口
11.5.管理接口
11.6.组件准备就绪
11.7.集成产品组件
11.8.评估已集成的产品组件
12.设计输出
技术解决方案的输出
项目的设计输出的包括的范围
面向生产制造的设计输出的组成
项目的设计输出的裁剪原则
设计输出在管理上的要求
13.设计转换
13.1.设计转换的疑惑
13.2.研发与生产的矛盾
13.3.认识逐步提高的过程
13.4.明确设计转换的目的
13.5.设计转换的输入和输出
13.6.设计转换的关注要点
14.设计验证与确认
14.1.验证与确认的联系与区别
14.2.验证与确认的问题举例
14.3.验证与确认的管理要求
14.4.验证与确认的关注要点
组件级的验证
样品级的验证
★示例:样品验证报告
14.5.产品确认
产品确认包括的内容
★示例:产品确认报告
安全性和临床性能摘要(SSCP)
15.设计评审
15.1.评审低效的表现
15.2.评审的成熟度
15.3.缺陷纠正放大律
15.4.有关评审收益的报告
15.5.评审目标
15.6.评审模式
15.7.评审计划
15.8.评审文化
15.9.评审团队
15.10.设计指南
15.11.过程定义
15.12.决策机制
15.13.度量分析
15.14.评审流程
15.15.评审管理
演练:用一个实际的工作产品进行评审,完成评审全过程。
16.CPAP、更改
16.1.不良事件的监视信息系统
原型样品开发阶段
设计转换阶段
生产及生产后阶段
16.2.CAPA有关基本概念
不合格、纠正、纠正措施、预防措施
对不良事件的风险评估
16.3.更改的管理上的要求
16.4.更改的类型
16.5.工程变更专题讨论
DCN、PCN、ECN、SCN、TCN
16.6.更改中风险管理
设计转换阶段更改的风险管理
生产或生产后更改的风险管理
17.产品开发的策划与风险管理
17.1.组织级策划和项目级策划
17.2.项目计划中的风险管理计划
17.3.项目团队与风险管理的责任
案例:某公司风险管理“认真走形式”的原因分析
17.4.将风险管理与可靠性工程的结合起来
18.生产后信息与风险管理
18.1.上市后监督计划(post-market surveillance/PMS Plan)
上市后监督计划的要求
18.2.上市后的监督体系
将上市后监督计划体系化的好处
基于FRACAS的上市后监管体系
案例:迈瑞上市监管体系的运作
产品质量指标的确定、执行控制、检查与趋势分析、持续改进。
18.3.上市后临床跟踪计划(POST MARKET CLINICAL FOLLOW-UP/PMCF Plan)
案例:PMCF模板。
18.4.上市后性能跟踪计划(POST MARKET PERFOMANCE FOLLOW-UP/PMPF Plan)
18.5.定期安全更新报告 (Periodic safety update report /PSUR)
案例:定期安全关系报告模板。

